梭狀芽孢桿菌是一個多樣化的革蘭氏陽性菌屬,專性厭氧,在環境中普遍存在。這個屬大約包含了100多個種,基因組內總體的G+C含量范圍在22-55%,反映出該屬內的細菌在系統進化關系上的巨大差異。
該屬內最主要的食源性致病菌為肉毒梭菌和產氣莢膜梭菌,它們均可通過毒素介導,通過直接產生毒素(如食源性肉毒中毒),或在腸道內生成毒素(如嬰兒肉毒中毒和產氣莢膜梭菌腹瀉),從而引發食源性細菌性疾病。
肉毒梭菌簡介
肉毒梭菌(Clostridium botulinum)屬于厭氧性梭狀芽孢桿菌,為革蘭氏陽性的多形態大桿菌,芽孢位于菌體近端,使菌體呈匙形或網球拍狀。根據抗原性的不同,肉毒梭菌可分為8個型,分別是A、B、Cα、Cβ、D、E、F和G型。
肉毒梭菌產生的外毒素稱為肉毒神經毒素(BoNTs,botulinum neurotoxins),肉毒毒素在目前已知毒素中毒性最強,一個人的致死劑量大約為1 µg,比氰化鉀毒力大10000倍,和炭疽一樣,可作為生物武器。BoNTs可引發食物中毒,即肉毒中毒,能夠引起人類中毒的主要型別為A、B和E型。肉毒中毒的臨床表現不同于其他食物中毒,胃腸道癥狀很少見,主要為神經末梢麻痹,發病率不高,但死亡率居細菌性食物中毒之首。
肉毒梭菌是一種腐物寄生菌,在自然界分布廣泛,食物中肉毒梭菌主要來源于環境,如塵埃、糞便等,尤其是帶菌土壤。肉毒梭菌的抵抗力一般,在45℃以上都受到抑制,80℃經20min可被殺滅。但其芽孢的抵抗力極強,可耐煮沸長達1-6h之久,于180℃干熱5-15min或于120℃高壓蒸汽下10-20min才能滅活,在酒精中可存活2個月,10%的HCl需60min才能破壞芽孢。蛋白分解型的肉毒梭菌(A、B和F型)芽孢比非蛋白分解型的B、E和F型的芽孢對熱具有更強的抵抗力。芽孢在厭氧環境的食品中可發芽繁殖產生肉毒毒素,人類因食入已產生毒素的食品而發生肉毒中毒。另外,因肉毒梭菌隨蜂蜜等食物進入嬰兒腸道內產毒引發的嬰兒肉毒中毒也有存在。
肉毒梭菌的形態特征和分類學

肉毒梭菌為多形態的厭氧性的桿狀菌,長約4-6?m,寬約0.6-1.2 ?m,兩側平行,兩端鈍圓,直桿狀或稍彎曲,可形成芽孢,卵圓形,位于次級端或偶有位于中央,常見很多游離芽孢,多單在,偶見成雙或短鏈,A型和B型菌的芽孢大于菌體,位于菌體近端,使菌體呈匙形或網球拍狀,其他的型芽孢一般不超過菌體寬度。有時呈現長絲狀或鏈狀,有時能見到舟形、帶把柄的檸檬形、蛇樣線狀和染色較深的球莖狀,這些屬于退化型,當菌體開始形成芽孢時,常常伴隨著自溶現象。肉毒梭菌具有4-8根周生性鞭毛,運動遲緩,沒有莢膜。
根據《伯杰氏細菌鑒定手冊》,肉毒梭菌歸屬為原核生物界、厚壁菌門、厚壁菌綱、芽孢桿菌科的梭菌屬(Clostridium)。
肉毒梭菌這個種是基于單一的表型特征,即產生BoNTs的這個特性來分類定義的。Collins等(1998)又將其分為4個組(Group I-IV),這些群呈現出非常多樣化的基因型和表型特征(見表一),菌株之間的差異程度要遠遠超過枯草芽孢桿菌(Bacillus subtilis)和金黃色葡萄球菌(Staphylococcus aureus)菌株之間的差異程度。
這種情況有時更為復雜,導致分類學上的困難,因為有些菌株從發育關系上來說與肉毒梭菌非常相近,但是并不產生神經毒素,因而沒有歸入肉毒梭菌這個種,如生孢梭菌(Clostridium sporogenes),諾維氏梭菌(Clostridium novyi),和其他一些未命名的梭菌;而有些菌株能生產神經毒素,卻因系統發育較遠,并未歸入肉毒梭菌,如巴氏梭菌(Clostridium baratii)以及酪酸梭菌(Clostridium butyricum)。更復雜的情況是,Collins等(1998)還發現BoNTs的毒力基因能在菌株間不穩定地平行轉移,從而產生不產毒的變種,或是攜帶部分或未知的BoNTs基因。正因為肉毒梭菌的種內多樣性,導致了對于該細菌的分類學研究仍存在爭議,給各種肉毒梭菌的檢測、分離和鑒定方法,甚至是16S測序法鑒定都帶來了一定的難度。
表一:肉毒梭菌的基本特征
特征 | 組I | 組II | 組III | 組IV |
毒素類型 | A, B, F | B, E, F | C, D | G |
人類疾病病原 | 是 | 是 | 是 | 否 |
最低生長溫度(℃) | 10 | 3.3 | 15 | 不確定 |
最適生長溫度(℃) | 35-40 | 18-25 | 40 | 37 |
最低生長pH值 | 4.6 | 5.0 | 5.0 | 不確定 |
最低生長水活度Aw | 0.94 | 0.97 | 不確定 | 不確定 |
氯化鈉抑制 | 10% | 5% | 2% | 不確定 |
芽孢D100℃值(分鐘) | 25 | < 0.1 | 0.1-0.9 | 0.8-1.12 |
芽孢D121℃值(分鐘) | 0.1-0.2 | < 0.001 | 不確定 | 不確定 |
蛋白分解活性 | 是 | 否 | 否 | 微弱 |
脂肪分解活性 | 是 | 是 | 是 | 否 |
糖分解活性 | 否 | 是 | 微弱 | 否 |
相近的非產毒梭菌屬菌種 | C. sporogenes C. putrificum | C. beijerinkii | C. novyi C. haemolyticum | C. subterminale C. histolyticum C. linosium |
毒力基因位置 | 染色體 | 染色體 | 噬菌體 | 質粒 |
基因組G+C含量(mol%) | 26-29 | 27-29 | 26-28 | 28-30 |
肉毒梭菌的傳統鑒定和分離方法
正如前述,肉毒梭菌這個種是基于單一的表型特征,即產生BoNTs的這個特性來分類定義的,所以傳統的表型和基因型鑒定方法,如生化反應、細胞脂肪酸組分分析以及16S測序等并不能給出明確的鑒定結果,見Collins(1998),Brett(1998),Ghanem(1991)。比如,16S測序方法已被證實無法區分肉毒梭菌及其兩個近親:諾維氏梭菌(Clostridium novyi)和生孢梭菌(Clostridium sporogenes)。
肉毒梭菌培養分離的第一步是增菌培養基及培養條件的確定。培養基可優先選用預還原性(Pre-reduced)厭氧無菌的熟肉基質培養基(可含或不含葡萄糖成分)(cooked meat medium),碎肉葡萄糖淀粉培養基(chopped-meat glucose-starch medium),或胰蛋白胨葡萄糖酵母提取肉湯(tryptone-peptone glucose yeast extract broth)。胰蛋白酶可被添加到配方中以滅活細菌素和激發神經毒素。溶菌酶的加入有助于復活熱損傷的孢子,尤其適合于非蛋白分解型肉毒梭菌的菌株。
由于不同組別的肉毒梭菌的最適生長條件并不統一(見表一),所以最優的培養溫度的選擇仍然是個問題。Solomon(2001)等推薦采用28℃用于II組肉毒梭菌的培養,而用35℃用于其他組別的培養,不過目前已經有質疑認為其不適用魚類和貝殼類食品中肉毒梭菌的檢測。Anon(1998)等推薦采用30℃用于所有組別的菌株的培養,但在這個條件下I組的菌株得不到最優的生長。
培養5天后,接種的肉湯需做小鼠生物實驗(Mouse Bioassay)以檢測BoNTs的產生情況。另需培養10天以檢測受損芽孢或延遲產芽菌株的生長情況仍然是十分必要的。所有的培養物還需最終通過鏡檢檢測,觀察菌株的形態特征,以獲得鑒定結論。
疑似陽性的肉湯樣本,連同疑似原因食品和臨床樣本(尤其是糞便)還需選用上述培養基進行嚴格厭氧環境下的二次培養以進行確認。培養基需包含以下成分:
卵黃:以檢測酯酶陽性的肉毒梭菌菌株,見Silas(1985)
選擇性抗菌劑:環絲氨酸,磺胺甲基異惡唑,甲氧芐啶等,見Silas(1985),Dezfulian(1981),Mills(1985)
由于肉毒梭菌不同組別菌株存在較大差異(尤其是I組和II組),專家們一致建議采用含抑菌劑和不含有抑菌劑的選擇性平板同時進行對照實驗,以便分析和獲得更為準確的結果。
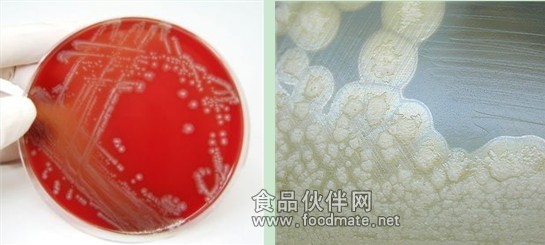
典型的肉毒梭菌的菌落形態見圖一:
Typical colonial growth of C. botulinum, together with an atypical lipase negative culture: Classically, C. botulinum colonies are usually gray-white on blood containing agars with circular irregular edges, and a clear zone of β-hemolysis.

Clostridium botulinum growing on blood agar (Below Left)
Clostridium botulinum growing on egg yolk agar showing the lipase reaction after 72 hours of incubation (Below Right)
主要的肉毒梭菌的生化特征見表二和表三:
表二:各型肉毒梭菌的生化特性
型別 | A | B | C | D | E | F |
葡萄糖發酵 | + | + | + | + | + | + |
麥芽糖發酵 | + | (±) | (±) | (±) | (±) | (±) |
乳糖發酵 | - | - | (-) | (-) | - | - |
蔗糖發酵 | (-) | (±) | - | - | - | (+) |
靛基質產生 | (±) | - | (-) | (-) | - | - |
明膠液化 | - | (+) | (±) | (±) | (±) | (+) |
牛奶消化 | (+) | (±) | - | - | - | (+) |
注:肉毒梭菌的生化形狀并不規律,即使同型也常見到株間差異;+表示陽性,-表示陰性,(±)表示視菌株而定,(+)表示多為陽性反應,(-)表示多為陰性反應。
表三:各組肉毒梭菌的生化特性
組別 | I組 | II組 | III組 | IV組 | |||||||
芽孢位置 | S | T | S | T | S | T | S | T | |||
動力 | + | - | + | + | - | + | |||||
有氧環境 | - | - | - | - | |||||||
葡萄糖 | + | + | + | - | |||||||
乳糖 | - | - | - | - | |||||||
麥芽糖 | - | + | d | - | |||||||
甘露醇 | - | - | - | - | |||||||
卵磷脂酶 | - | - | - | + | - | ||||||
酯酶 | + | + | + | - | |||||||
七葉苷水解 | + | - | - | - | |||||||
肉渣消化 | + | - | + | - | + | - | |||||
明膠液化 | + | + | + | + | |||||||
吲哚產生 | - | - | - | + | - | ||||||
牛乳反應 | d | c | - | d | d | ||||||
硝酸鹽還原 | - | - | - | - | |||||||
脲酶 | - | - | - | - | |||||||
肉毒梭菌的Ribotyping鑒定及分子分型
正因為肉毒梭菌的種內菌株的多樣性及其16S序列的高度保守性使得生化鑒定和16S測序鑒定等傳統技術對肉毒梭菌的鑒定存在諸多難點,所以研究者們不遺余力應用更多分子生物學技術以縮短肉毒梭菌的鑒定時間,簡化鑒定流程,增加鑒定結果的準確性和重現性。
Ribotyping(核糖體分型)是首個用于細菌鑒定和分型的分子指紋技術,無需依賴PCR技術,因此可避免非特異擴增問題,具有較高的保真性。其是在RFLP(限制性片段長度多態性)和Southern Blot印跡基礎上發展起來的一種鑒定和分型方法,它將細菌的全基因組DNA用限制性內切酶消化,經電泳分離和Southern Blot轉印后,用放射性標記的rRNA操縱子探針雜交,根據帶型和帶數的多態性對細菌進行分子分型,同時因圖譜本身具備系統分類學的意義,因此可將圖譜與標準菌株數據庫的指紋模式(Ribo Pattern)進行比對,實現鑒定和分子分型的同步完成。
該方法的優點之一是廣譜性、通用性和特異性兼顧。由于核糖體編碼基因有較高的保守性,各種限制性酶切位點在細菌基因組內也廣泛分布,因此可用一種通用的探針和酶切方案對多種不同的微生物進行檢測,實現廣譜分析,特別適合未知病原菌的篩查和溯源,也滿足大規模檢測及食物中毒應急檢測的需求。用戶也可為某一特定種屬的細菌進行酶切方案和探針的探索及優化,選用單一酶切或混和酶切的條件,及更為特異的探針,滿足更高特異性和分型力的需求,建立個性化的菌株指紋圖譜數據庫,見Grimont(1986)。
該方法的另一大優點是分型力較好。由于核糖體是細菌體內重要的蛋白質合成“工廠”,細菌通常具有多個核糖體編碼基因以滿足新陳代謝需要。通過Ribotyping,可獲得足夠數量不同分子大小的指紋條帶(一般為5~15條),具備較高的分型率和良好的重復性,分型圖譜穩定性高、條帶多,見Anne(1991)。
Schalch等(1997)曾采用Ribotyping技術對10個食物中毒暴發事件中收集而來的34株產氣莢膜梭菌(Clostridium perfringens)進行了分型,得到了12種指紋模式(Ribotype),且從原因食品中和病人糞便樣本中分離得到的菌株的指紋模式高度吻合。
Hielm等(1999)首次采用Ribotyping技術對68株肉毒梭菌和5種相關的梭菌屬菌種進行了鑒定和分型,以考察該技術對引發中毒的肉毒梭菌的鑒定和分型能力。他們先后試驗了13種限制性內切酶,最終選擇以EcoR I和Hind III的酶切方案進行鑒定和分型。這兩種酶切方案及Ribotyping技術均顯示出了良好的鑒定和分型效果,可以顯著的區分蛋白分解型和非蛋白分解型的肉毒梭菌菌株,并被推薦為肉毒梭菌種屬鑒定的優選方法。
他們隨后用GelCompar軟件對兩種酶切方案得到的指紋圖譜進行了分型力分析以及UPGMA分析。結果顯示(見表四、圖二和圖三),EcoR I酶切獲得的Ribotyping指紋圖譜分型效果最好,分型指數(Discriminatory Index)高達0.982;Hind III酶切的分型能力也相當,分型指數為0.954。聚類分析的結果顯示,各菌株間的Dice相似系數為35±13%(中值±標準差)。這些結果都表明Ribotyping技術非常適合用于肉毒梭菌的鑒定和分子分型。
Hielm等還認為,對于肉毒梭菌,Ribotyping的分型能力與PFGE(脈沖場凝膠電泳)相當,且其圖譜具備PFGE所缺乏的細菌分類學意義,因此可用于肉毒梭菌的鑒定,而PFGE圖譜則因其隨機酶切的性質,無法用于鑒定。另一方面,隨著自動化的Ribotyping技術(杜邦RiboPrinter? System)的問世,大大簡化了鑒定和分型流程,相比繁瑣和對操作技術要求較高的PFGE技術具有顯著的優勢。
表四:Ribotyping技術用于肉毒梭菌及其他梭菌屬菌株的分型能力分析

圖二:肉毒梭菌EcoR I酶切的Ribotyping指紋圖譜的聚類分析

圖三:肉毒梭菌Hind III酶切的Ribotyping指紋圖譜的聚類分析

自動化的Ribotyping技術已經在病原微生物的風險分析和關鍵點控制(HACCP)體系、GMP體系、食品和藥品安全質控和質保、常規檢測、環境監測、法規制定和基礎研究等領域引起了廣泛的關注并得到了長足的應用。
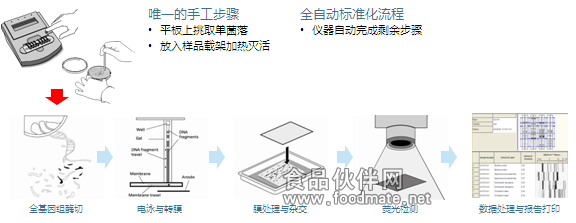
隨著美國杜邦公司的RiboPrinter®系統的問世,Ribotyping技術實現了全自動化和標準化(見圖四)。因其出眾的性能、簡單的操作,RiboPrinter®系統已經成為世界眾多微生物學、分子生物學實驗室開展微生物鑒定和分子分型的首選設備,具備如下特點:
1.高通量,檢測速度快,鑒定加分子分型8小時內同步完成
2.結果準確,重復性和重現性好
3.廣譜的鑒定和分型能力,未知菌株可直接上機,無需預檢
4.通用試劑盒適用已知和未知細菌的鑒定和分型,及大規模篩查和應急檢測需求
5.開放平臺可滿足更高特異性檢測和個性化研究需求
6.支持種屬特異試劑盒和多酶切方案滿足更高分型力需求或建立菌株數據庫
7.操作簡單,自動化程度高,標準化流程內設,結果自動判讀,非經驗豐富人員也只需簡單培訓即可使用,節省不必要的用地和設備,人員8.培訓更簡單,成本更低
9.標準數據庫容量為8528個基因模式,包括1741個種和297個屬,標準菌株均來源ATCC(美國模式培養物研究所)、JCM(日本微生物菌種保藏中心)和DSMZ(德國微生物菌種保藏中心)。涵蓋環境菌(如葡萄球菌、微球菌、芽孢桿菌、梭菌屬等);致腐菌(芽孢桿菌、假單胞菌、明串珠菌、梭菌屬等);致病菌(腸出血性大腸桿菌、沙門氏菌、金黃色葡萄球菌、志賀氏菌、單增李斯特菌、弧菌、彎曲桿菌、阪崎腸桿菌等);益生菌(乳酸桿菌、雙歧桿菌、乳球菌、嗜熱鏈球菌等)等多種類型
圖四:杜邦RiboPrinter® System全自動微生物基因指紋鑒定系統及流程

Bruce等(1995 & 1996)和Webster等(1994)曾證明在沙門氏菌和單增李斯特氏菌菌株分型技術方面,RiboPrinter?系統比傳統技術更為有效。
Wiedmann等(1996)曾成功用RiboPrinter®系統追溯到產品和環境中單增李斯特氏菌的污染,在動物源性病原菌疾病暴發的控制方面起到了積極作用。無獨有偶,Bruce等(1996)也成功用RiboPrinter®系統追溯到了食品加工廠環境中的金黃色葡萄球菌污染。
在Hielm等人的研究基礎上,Skinner等(2000)采用RiboPrinter®系統對30株肉毒梭菌和1株生孢梭菌的鑒定和分型能力進行了進一步的研究,獲得了成功。
他們開展該工作的原因之一,是因為Hielm等(1998)曾報道,采用PFGE對非蛋白分解型肉毒梭菌進行分型比較困難,很難獲得高質量的指紋圖譜。而且在分析B、E、F三型非蛋白分解型肉毒梭菌時,菌株DNA的降解成了一個非常困擾的問題。而此前,Samore等(1996)已經報道了,在33株難辨梭菌(Clostridium difficile)的分型工作中,PFGE對其中的23株都沒有成功分型,推測的原因也是菌株DNA的意外降解。
這31株各型的肉毒梭菌(見表五)均來自于美國食品藥品監督管理局和罐頭食品企業,被接種于改良的厭氧卵黃瓊脂培養基上,在35℃下培養24h。用3mL緩沖液(2 mM Tris + 20 mM EDTA)淋洗平板及用滅菌接種針刮擦平板表面以獲得營養細胞,制成30µL每管的細胞混懸液,直接用于RiboPrinter®系統分析,經系統自動的加熱滅活、裂解、標準EcoR I酶切及后續分析等流程,獲得了較為理想的結果。
表五:Skinner等用于分析的肉毒梭菌菌株表


31株菌的分型結果如表六和圖五所示。Skinner等定義菌株相似度>93%的圖譜被歸為一個Ribogroup,故31株菌可被分成15個Ribogroup,并顯示了較高的重現性。其中23株蛋白分解型菌株(含A型和B型),5株非蛋白分解型菌株(B型)和2株E型菌株及1株生孢梭菌均得到了高分辨的分型。
表六:31株肉毒梭菌和產氣莢膜梭菌菌株經EcoR I酶切的Ribogroups模式列表

圖五:30株肉毒梭菌經EcoR I酶切獲得15組Ribogroup圖譜

Skinner等隨即對菌株的來源和菌株的分組進行了綜合分析,證實了RiboPrinter®系統在菌株溯源方面的應用價值,見表七。
表七:部分肉毒梭菌菌株的追溯和圖譜分析
Ribogroup | 菌株 | 來源與圖譜分析 |
128-1 | CAM3-A, CAM5-B | 來源于同一個雞肉蔬菜湯罐頭加工廠,來自于同一個生產批次的兩個罐頭樣本,分型結果在同一個Ribogroup |
137-3 | OS3-A, 4896-A | 均從1983年美國伊利諾伊州肉毒梭菌食物中毒事件中收集而來,其中4896-A來自病人的糞便,OS3-A來自于最終確認的原因食品——炒洋蔥,這兩株菌不僅被分在了一個Ribogroup中,且指紋圖譜相似度高達99% |
121-7 | Mush2-B, Mush3-B | 均來自于1975年同一批次生產的鮮蘑菇,分型結果在同一個Ribogroup |
121-7 | 383-B, 642-B | 來源于1972-1973年生產的兩個批次鮮蘑菇樣本,分型結果在同一個Ribogroup |
137-8 | C. sporogenes PA 3679 | 該生孢梭菌的圖譜與A型肉毒梭菌的相似,從細菌分類學上很容易得到解釋,因為其與組I肉毒梭菌具有相似的培養和生化特征,唯一的區別是不會產BoNTs |
從表七中可以看出,來源相近的肉毒梭菌菌株最終被追溯到同一個Ribogroup組別(如128-1, 137-3, 121-7,),而生化性質與肉毒梭菌接近的生孢梭菌則被分為了一個新的Ribogroup組別(如137-8),體現了RiboPrinter®系統較好的菌株追溯能力,及干擾菌株的排他能力,這在食物中毒病原體追溯、原因食品追溯、流行病學調查、院內感染、生產環境監測和污染源追溯等領域有十分重要的應用價值。
圖六:29株肉毒梭菌經EcoR I酶切獲得的9組Ribogroup圖譜

Kennett等(2006)也采用RiboPrinter®系統及EcoR I酶切方案,對梭菌屬的7種,共計49株可引發食源性疾病的梭菌菌株進行了鑒定和分型,包括:耐氧梭菌(Clostridium aerotolerans),拜氏梭菌(Clostridium beirjerinckii),腐敗梭菌(Clostridium putrificum),肉毒梭菌,酪酸梭菌,產氣莢膜梭菌和生孢梭菌。Kennett等同時設計了EcoR V酶切方案消化17株肉毒梭菌,以考察不同酶切方案對鑒定和分型效果的改善作用。結果證實RiboPrinter®系統可以較好地鑒定和分型這些梭菌屬的菌株,還可通過調整限制性酶切方案來分型不同表型和產毒型的菌株,可選的限制性內切酶除了EcoR I和EcoR V之外,還可選Cla I,Hind III,Spe I,Rsa I等,部分圖譜可見圖六。
綜上所述,杜邦RiboPrinter® System在肉毒梭菌及其他梭菌屬細菌的鑒定和分子分型領域有著廣闊的應用前景和突出的使用價值。依托杜邦的行業領先技術,該鑒定分型產品的技術路線可有效地保障政府檢測機構、第三方檢測實驗室、研究院所和食品、藥品企業快速、準確、標準化地鑒定和分型肉毒梭菌,建立菌株信息庫,有效追溯污染菌株,從而預警和控制潛在的肉毒梭菌暴發和致命食源性疾病發生的風險。











